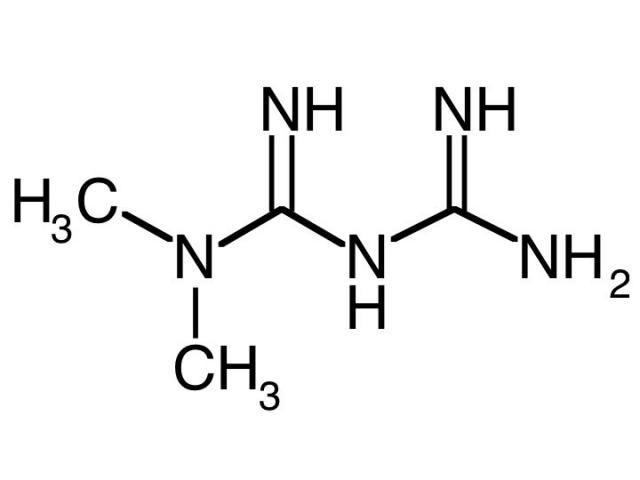
HATÓANYAG NEVE, KÉPLETE, MEGJELENÉSI FORMÁJA | |
Név | 1-(diaminometilidén)-3,3-dimetil-guanidin (1) |
Vegyületcsoport | orális antidiabetikus készítmények, nem inzulinotróp, biguanidok (4) |
CAS szám | 657-24-9 (1) |
Molekulaképlet | C4H11N5 (3) |
Megjelenés | gyógyszeripar (8) |
ALKALMAZÁS, HATÁSOK | |
Alkalmazás, | Alkalmazása során a testsúly nem nő, hypoglykaemia nem alakul ki, az inzulinszint vagy változatlan marad, vagy kissé csökken. Előnyösen változik a kezelés során a haemostasis egyensúlya is, a PAI-1 koncentrációja alacsonyabb lesz, valamint enyhe vérnyomáscsökkenést is megfigyeltek. (4) |
Elsődleges hatás | A vércukor és a lipidek szintjét csökkenti. A triglicerid, az össz- és az LDL-koleszterin szintet csökkenti, emeli a HDL-koleszterin-koncentrációt. (4) |
Mellékhatások | A biguanidok legfőbb mellékhatása a tejsav-acidózis, mivel gátolják a májban a glükoneogenezist, ugyanakkor segítik a periferiális glükózfelhasználást. A metformin esetén ez az arány 100.000 betegből évi 3 eset. Ezt elkerülendő tilos metformint adni szív-, tüdő-, máj- és vesebetegségben, megfeszített fizikai munkában, napi 1000 kcal alatti kalóriamegszorításban, rendszeres alkoholfogyasztás esetén és terhességben. A biguanidok lassítják a bélben a glükóz felszívódását, ami emésztési zavarokat, hányingert, hasmenést, hasi görcsöket okozhat, különösen a kezelés kezdetén. A mellékhatások csökkenthetők a metformin fokozatos bevezetésével, és csökkennek ill. megszűnnek a kezelés során. (3) Fémes szájíz, puffadás, émelygés, laza széklet, esetleg hasmenés. (4) |
FIZIKAI-KÉMIAI TULAJDONSÁGOK | |
Moláris tömeg | Átlagos: 129,1636 Monoizotópos: 129,101445377 (1) |
Sűrűség | - |
Olvadáspont | 223-226℃ (5) |
Forráspont | 224,1°C at 760 mmHg (5) |
Gőznyomás | 0,0929 mmHg 25°C-on (7) 0,0034 mmHg 25°C-on (9) |
Vízoldhatóság | Kísérleti tulajdonság: Szabadon oldódik, mint a HCl só (1) Becsült tulajdonság: 1,38e+00 g/l |
Stabilitás | A termék stabil. (5) |
Hidrolízis | - |
Fizikai, kémia, biológiai állandók | |
H, Henry-állandó | 7,6X10-16 atm-cu m/mole (9) |
Kow | Log Kow -1,4 (6) |
Koc [l/kg] | 27 l/kg (6) |
pKa | 12,4 (1) Kísérleti tulajdonság 12,1 (6) |
BCF, biokoncentráció | 3,2 (9) |
VISELKEDÉSE A KÖRNYEZETBEN | |
Abiotikus degradálhatóság és | - |
Biodegradálhatóság és | - |
KÖRNYEZETMINŐSÉGI KRITÉRIUMOK | |
Határértékek | - |
MÉRT KONCENTRÁCIÓJA A KÖRNYEZETBEN | |
Koncentrációja a környezetben (mérési adat) | - |
ÖKOSZISZTÉMÁRA GYAKOROLT HATÁS | |
Vízi ökoszisztémára gyakorolt hatások | |
Akut toxicitási adatok (LC50, EC50) | Daphnia EC50: 130 ppm (10) |
Krónikus toxicitási adatok (NOEC, LOEC) | Bluegill NOEC: 982 ppm (10) |
Szárazföldi ökoszisztémára gyakorolt hatások | |
Akut toxicitási adatok (LC50, EC50) | Akut orális toxicitás (LD50): 350 mg/kg (nyúl). Várható hogy a mellékhatások intenzívebb epigastrialis diszkomfort, hányinger, hányás, hasmenés követ, álmosság, gyengeség, szédülés, rossz közérzet, fejfájás figyelhető meg. (7) Az állatkísérletek során semmiféle speciális érzékenységet nem találtak (8) |
Krónikus toxicitási adatok (NOEC, LOEC) | Patkányon (18 hónapos), kutyán (18 hónapos) és majmon (2 éves) krónikus toxikológiai vizsgálatok során semmilyen molekulaspecifikus hatást sem észleltek. (7) |
EMBERRE GYAKOROLT HATÁS | |
Általános káros hatások | - |
Lebontás az emberben, távozása a szervezetből | Vesén át, osmotikus diuresissel ürülő. Parenteralisan adott jódos kontrasztanyagokkal végzendő vizsgálatok (uro-, angiographia, CT) előtt 48 h-val adását fel kell függeszteni, s csak 48 h-val a vizsgálat befejezése után adható vissza. Sürgős vizsgálat szükségessége esetén a teendőket a beteg hidráltsága és a veseműködés állapota határozza meg. Kellően hidrált állapot és normális vesefunkciós értékek -szérum creatinin férfin <130, nőn < 110 umol/l, GFR > 70 ml/min- mellett a vizsgálat várakozás nélkül elvégezhető, de utána 48 h-ig a készítmény adását szüneteltetni kell. Beszűkült veseműködés, illetve exsiccosis esetén infusio adandó, megfelelő diuresis biztosítottsága és az értékek rendeződése esetén a vizsgálat elvégezhető. (11) |
Endokrin rendszert károsító | - |
Immunrendszert károsító | - |
Szövetkárosító | - |
Mutagén | A metformin mutagén hatásait a kívántnál szűkebb körben vizsgálták. Baktériumokon végzett mutagenitás-teszt negatív eredményű volt, míg egyes emlőssejtek in vitro vizsgálatakor kromoszóma-elváltozásokat figyeltek meg. Ezen megfigyeléseknek relevanciája nem tisztázott. A metformin tartós alkalmazása során állatkísérletekben nem észlelték tumorindukáló hatását. (12) |
Karcinogén | A hosszútávú állatkísérletek a metformin karcinogén tulajdonságára vonatkozó adatokat nem hoztak.(13) |
Reprotoxikus, teratogén | A metformin a vizsgált dózistartományokban patkányokon nem bizonyult teratogénnek. 300 mg/ttkg/nap adagig nem bizonyult embrio-, fötotoxikusnak a petebeágyazódást befolyásoló hatásokat is beleértve. A hímivarsejtek fertilitását 600 mg/ttkg/nap adagig nem befolyásolta. Nyulakon 140 mg/ttkg/nap adagig (orális alkalmazás esetén) nem volt teratogén hatású, patkányokon 600 mg/ttkg/nap dózishatárig (orális adagolás esetén) sem pre-, sem postnatalis expozíciónak kitett állatokon nem okozott semmilyen eltérést. (12) |
Akut toxicitási adatok (LD50) | Az akut toxicitást különböző beadási utakon, és különböző állatfajokon vizsgálták. |
Krónikus toxicitási adatok (NOEL, LOEL) | A metformin ismételt adásával patkányokon (18 hónapig), kutyákon (18 hónapig) és majmokon (2 évig) végzett vizsgálatok specifikus toxikus hatást nem igazoltak. Reproduktív toxicitás: |
EGYÉB JELLEMZŐK | |
| - |
Forrás:
- http://www.drugbank.ca/drugs/DB00331
- http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=4091#x321
- http://hu.wikipedia.org/wiki/Metformin
- http://www.lam.hu/folyoiratok/lam/0104/7.htm
- http://www.chemnet.com/cas/hu/1115-70-4/Metformin%20HCL.html
- http://www.sniffer.org.uk/Webcontrol/Secure/ClientSpecific/ResourceManagement/UploadedFiles/ER09_Literature_Review_Interim_Report.pdf
- http://www.chemspider.com/Chemical-Structure.3949.html
- http://www.ogyi.hu/kiseroirat/ah/ah_0000023301_20060131123221.doc
- http://toxnet.nlm.nih.gov/cgi-bin/sis/search/f?./temp/~XNbghj:1
- http://rivm.openrepository.com/rivm/bitstream/10029/7379/1/601500002.pdf
- http://www.medlist.com/HIPPOCRATES/VII/4/221main.htm
- http://www.fortuna-patika.hu/WEB-Patika_m85/Termekek_m92/_t1863/_pagealkalmazasieloirat
- http://www.freeweb.hu/ezustkehely/hatastan.php?id=9990000116249&hat=210075805&eloirat=ok&PHPSESSID=ac9cd8f668c1adf15b164cb7824ecf21