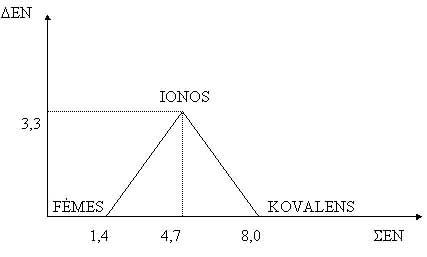
Az atomok közti kötés milyenségét alapvetően a EN különbsége és összege határozza meg.
Minél nagyobb a ΔEN a kötés annál polárisabb, a molekula dipólusos lesz, melynek nagyságát a dipólusmomentum adja meg, nagy ΔEN esetében molekuláról már nem is beszélhetünk a kötés ionos lesz.
• Ált. ionos a kötés, ha ΔEN>2.
• Ha ΔEN=0, vagy ≤ 0.5 akkor apoláris a kovalens kötés
• Ha 0.5 ≤ΔEN≤ 2.0 a kovalens kötés polaritása nő, ionosba megy át.
• A fémes kötés olyan elemek, atomok között alakul ki, melynek ΔEN pici és a ΣEN is kicsi.
A kötést létesítő atomok EN összege azt az erőt jellemzi, amely a kötést létrehozó elektronpárt a két atom közé rögzíti, lokalizálja. Nagy ΣEN esetén stabil kétatomos molekulák jönnek létre, ha ΣEN kicsi, akkor delokalizált kötés, többatomos molekulák jönnek létre.
A ΣEN-t tekintve van olyan eset mikor ez az érték nagy, de a ΔEN kicsi, ilyenkor kovalens a kötés.